Sel Volta: Pengertian, Prinsip-prinsip, Rangkaian dan Contohnya Lengkap


JAKARTA, iNews.id - Sel volta menjadi salah satu materi yang dipelajari dalam pelajaran Kimia. Berikut pengertian, prinsip, rangkaian hingga contohnya agar semakin mengerti.
Sel vota merupakan bagian dari sel elektrokimia, yaitu bagian ilmu kimia yang mengkaji hubungan energi listrik dengan energi kimia dari reaksi redoks. Materi ini sering kita jumpai dalam pelajaran kimia.

Perlu dipahami bahwa dalam reaksi redoks terjadi transfer elektron yang menghasilkan energi listrik. Karena reaksi redoks dapat dipisahkan menjadi dua setengah reaksi, maka sel volta pun dirancang menjadi dua tempat, yaitu tempat untuk reaksi oksidasi dan tempat untuk reaksi reduksi.
Sel Volta adalah seperangkat alat yang dapat mengubah energi kimia menjadi energi listrik. Alat ini ditemukan oleh Alessandro Volta dan Luigi Galvani dan dilengkapi dengan jembatan garam yang memiliki fungsi untuk menetralkan muatan antara kedua elektrode dan voltmeter yang berfungsi untuk mengukur tegangan.
Dikutip dari buku ‘Super Kimia SMA’ terbitan Wahyu Media, potensial sel volta dapat ditentukan dengan alat yang diberi nama volt meter atau potensio meter.
Adapun prinsip-prinsip yang perlu diperhatikan dalam rangkaian sel volta, yaitu sebagai berikut.
Dijelaskan bahwa reaksi spontan digunakan untuk membangkitkan arus listrik. Berikut gambarnya:
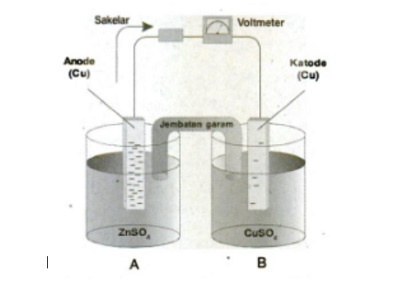
Hal itu dapat terjadi, karena arus listrik dapat dianggap sebagai aliran elektron. Setiap elektron membawa muatan sebesar 1,6 x 10-19 coulomb. Reaksi redoks merupakan reaksi pemindahan elektron. Elektron berpindah dari Zn ke Cu2+. Ion-ion Cu2+ menyelimuti logam Zn serta mengikat dua elektron dan kemudian mengendap.
Begitupun sebaliknya, logam Zn yang kehilangan dua elektron akan larut dan berubah menjadi Zn2+. Akan tetapi, reaksi seperti itu tidak menimbulkan arus listrik. Sebab, perpindahan elektron terjadi secara langsung, yaitu dari logam Zn ke logam Cu.
Namun, agar menghasilkan arus listrik, kedua logam tersebut harus dipisahkan dengan jembatan garam. Rangkaian yang dilengkapi dengan jembatan garam disebut dengan sel volta.
Reaksi yang terjadi di anoda: Zn(s) → Zn2+ (aq) + 2e
Cu2+ (aq) + 2e- → Cu(s)
Dengan melihat data nilai potensial reduksi standar, maka harga potensial sel yang dihasilkan dapat ditentukan sebagai berikut.
Zn(s) → Zn2+ (aq) + 2e EO = + 0,76 volt
Cu2+ (aq) + 2e- → Cu(s) EO = + 0,34 volt
—------------------------------------------------------------------------------------
Zn(s) + Cu2+ (aq) → Zn2+ (aq) + Cu(s) EOsel = 1,10 volt
Notasi dari diagram sel volta dapat ditulis : Zn / Zn2+ // Cu2+ / Cu
Potensial sel juga dapat ditentukan dengan persamaan berikut.
EOsel = EOreduksi - EOoksidasi
Sadarkah kamu bahwa contoh sel volta sering dijumpai dalam kehidupan sehari-hari? Berikut contoh sel volta untuk diketahui:
Akumulator (Aki)
Pada kendaraan bermotor, baterai berfungsi untuk penyalaan awal dan sebagai sumber arus listrik selama kendaraan digunakan. Rangkaian baterai ini dibuat untuk mengisi arus dengan menggunakan alternator dan penyearah arus yang telah terpasang pada kendaraan bermotor.
Baterai Kering atau Sel Leclanche
Baterai kering ditemukan oleh Leclanche. Sel Leclanche terdiri dari suatu silinder yang terbuat dari logam seng berisi pasta dari campuran batu kawi (MnO2), salmiak (NH4Cl), serbuk karbon, dan sedikit air.
Pasta tersebut berfungsi sebagai oksidator, logam seng berfungsi sebagai anoda, dan katoda berupa grafit yang merupakan elektrode inert. Katoda tersebut ditempatkan di tengah-tengah pasta.
Baterai Alkalin
Baterai alkalin mampu menyediakan arus listrik yang lebih stabil dalam waktu yang lebih lama dengan potensial yang tetap walaupun bahan pereaksinya telah berkurang. Pada sel alkalin, digunakan seng sebagai anoda dan MnO2 sebagai katoda.
Elektrolit yang digunakan adalah KOH dalam bentuk pasta. Sel ini disebut baterai alkalin, karena elektrolitnya berupa basa (alkalin).
Baterai Perak Oksida
Contoh yang terakhir adalah baterai perak oksida. Biasanya baterai ini dikemas dalam kemasan logam yang sangat kecil, karena penggunaan baterai ini untuk peralatan elektronik portabel, seperti jam tangan, kalkulator, dan pager.
Baterai ini terdiri atas anoda Zn dan Ag2O sebagai katoda. Elektrolit yang digunakan KOH berbentuk pasta. Ruang antara katoda dan anoda dipisahkan dengan separator.
Itu dia penjelasan sel volta beserta rangkaian dan cara kerjanya. Sebelumnya sudah tahukah kamu kalau aki merupakan contoh dari sel volta? Semangat belajar ya!
Editor: Puti Aini Yasmin