Ikatan Kovalen: Pengertian, Jenis, Sifat dan Contohnya

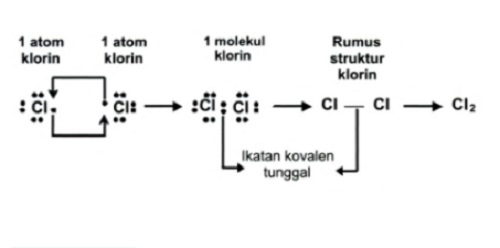
Ikatan kovalen tunggal adalah ikatan elektron yang digunakan bersama hanya satu pasang elektron. Contohnya adalah, pada pembentukan molekul klorin (Cl2)
17Cl : 2, 8, 7, jumlah elektron valensi = 7, yang berarti membutuhkan 1 e untuk mencapai kestabilan (oktet)
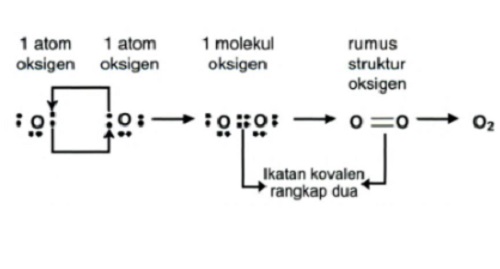
Ikatan ini merupakan elektron yang digunakan bersama dengan jumlah dua pasang elektron. Contohnya adalah pembentukan molekul oksigen (O2) :
8O : 2, 6, jumlah elektron valensi untuk = 6, yang berarti membutuhkan 2 e untuk mencapai kestabilan (oktet).
Ikatan ini merupakan elektron yang jika digunakan bersama berjumlah tiga pasang elektron.
Contohnya adalah pembentukan molekul nitrogen (N2) :
7N : 2, 5, jumlah elektron valensi = 5, yang berarti membutuhkan 3e untuk mencapai kestabilan (oktet)

Ikatan polar ini terjadi bila pasangan elektron yang dipakai bersama memihak atau mengutub ke salah satu atom atau gugus atom. Hal ini terjadi karena adanya perbedaan elektronegativitas yang besar antar atom yang berkaitan.
Elektronegativitas setiap unsur dapat dilihat pada tabel di bawah:

Contoh senyawa yang berikatan dengan kovalen polar adalah molekul HCl, yang di mana antara atom H dan Cl memiliki perbedaan elektronegativitas yang besar, yaitu H = 2,1 dan Ci = 3,0. Pasangan elektron yang dipakai bersama akan meng kutub ke arah atom Cl yang memiliki elektronegativitas yang lebih besar.
Ikatan nonpolar ini dapat terjadi apabila pasangan elektron yang dipakai bersama berasal dari atom yang sama, sehingga memiliki elektronegativitas yang sama seperti O2, H2, Cl2, F2, N2 dan sebagainya.
Selain itu, dapat hal ini juga dapat terjadi pada molekul yang simetris di mana satu atom diikat oleh beberapa atom yang sama sehingga pasangan elektron yang dipakai bersama tidak bergerak atau meng kutub ke salah satu atom. Contohnya seperti gambar di bawah :
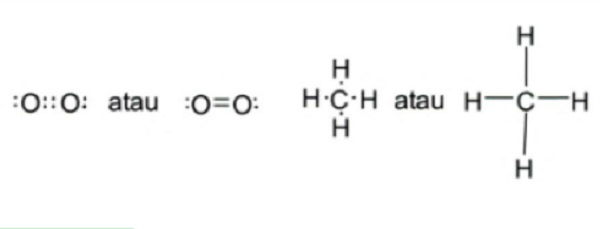
Ikatan koordinasi ini adalah ikatan kovalen yang terbentuk apabila penggunaan elektron bersama berasal dari salah satu atom yang berkaitan. Sedangkan atom lain menerima pasangan elektron yang digunakan bersama.
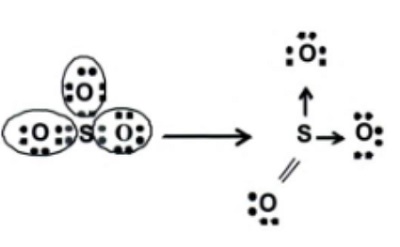
Pasangan elektron membentuk ikatan dativ digambarkan dengan anak panah kecil yang arahnya menuju atom yang menerima pasangan elektron. Contohnya adalah, ikatan koordinasi pada molekul belerang trioksida (SO3). Satuan ikatan S-O dalam SO3 adalah ikatan rangkap, sedangkan dua ikatan yang lain merupakan kovalen koordinasi. Hal ini terjadi karena atom pusat (S) memiliki 6 elektron valensi, jadi hanya memerlukan tambahan 2 elektron. Pembentukan senyawa ini dapat digambarkan dengan lambang Lewis seperti berikut ini :
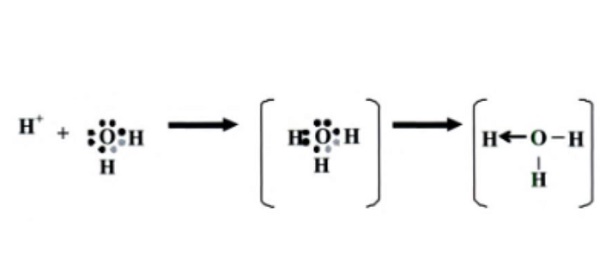
Ion hidronium ini terbentuk dari satu ion hidrogen yang terikat oleh satu molekul air.